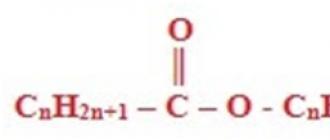Siiski väärib märkimist, et nende kasutamine avaldab inimorganismile tohutult positiivset mõju ning on tarbimiseks vajalik samamoodi nagu süsivesikuid ja valke.
Mis need estrid on?
Estrid või estrid, nagu neid nimetatakse ka, on oksohapete (süsinikud, aga ka anorgaanilised ühendid) derivaadid, millel on üldvalem, ja tegelikult on need tooted, mis vahetavad happelise funktsiooniga hüdroksüülrühmade vesinikuaatomeid - OH. süsivesinike jääk (alifaatne, alkenüül-, aromaatne või heteroaromaatne), loetakse neid ka alkoholide atsüülderivaatideks.
Levinumad estrid ja nende kasutusalad
- Atsetaadid on äädikhappe estrid, mida kasutatakse lahustitena.
- Laktaadid on piimhapped ja neil on orgaaniline kasutus.
- Butüraadid on õlised ja neil on ka orgaaniline kasutus.
- Formaadid on sipelghape, kuid nende suure toksiinide mahu tõttu neid eriti ei kasutata.
- Mainimist väärivad ka isobutüülalkoholil põhinevad lahustid, aga ka sünteetilised rasvhapped ja alküleenkarbonaadid.
- Metüülatsetaat – seda toodetakse puidupiirituse lahusena. Polüvinüülalkoholi tootmisel tekib see lisatootena. Lahustumisvõime tõttu kasutatakse seda atsetooni asendajana, kuid sellel on kõrgemad toksilised omadused.
- Etüülatsetaat - see ester tekib esterdamismeetodil metsakeemiaettevõtetes sünteetilise ja metsakeemia äädikhappe töötlemisel. Samuti saate metüülalkoholil põhinevat etüülatsetaati. Etüülatsetaadil on võime lahustada enamikku polümeere, näiteks atsetooni. Vajadusel saate Kasahstanis osta etüülatsetaati. Tema võimed on suured. Seega on selle eelis atsetooni ees üsna kõrge keemistemperatuuri ja väiksema lenduvusega. Tasub lisada 15-20% etüülalkoholi ja lahustumisvõime suureneb.
- Propüülatsetaadil on sarnased lahustumisomadused etüülatsetaadiga.
- Amüülatsetaat – selle aroom meenutab banaaniõli lõhna. Kasutusala - laki lahusti, kuna see lahustub aeglaselt.
- Puuvilja aroomiga estrid.
- Vinüülatsetaat – kasutusaladeks on liimide, värvide ja vaikude valmistamine.
- Naatrium- ja kaaliumisoolad moodustavad seepe.
Olles veidi uurinud ja uurinud estrite eeliseid ja kasutusala, saate aru, et need on inimelus tohutult vajalikud. Aidake kaasa arengule paljudes tegevusvaldkondades.
10.5. Estrid. Rasvad
Estrid– karboksüülhapete funktsionaalsed derivaadid,
molekulides, milles hüdroksüülrühm (-OH) on asendatud alkoholijäägiga (- VÕI)
Karboksüülhapete estrid – üldvalemiga ühendid.
R-COOR", kus R ja R" on süsivesinikradikaalid.
Küllastunud ühealuseliste karboksüülhapete estrid on üldine valem:

Füüsikalised omadused:
· Lenduvad, värvitud vedelikud
· Vees halvasti lahustuv
· Enamasti meeldiva lõhnaga
Kergem kui vesi
Estreid leidub lilledes, puuviljades ja marjades. Nad määravad oma spetsiifilise lõhna.
Need on eeterlike õlide koostisosad (teada on umbes 3000 e.m. - apelsin, lavendel, roos jne)
Madalamate karboksüülhapete ja madalamate ühehüdroksüülsete alkoholide estrid on meeldiva lillede, marjade ja puuviljade lõhnaga. Looduslike vahade aluseks on kõrgemate ühealuseliste hapete ja kõrgemate ühehüdroksüülsete alkoholide estrid. Näiteks mesilasvaha sisaldab palmitiinhappe ja müritsüülalkoholi estrit (müritsüülpalmitaat):
CH3(CH2)14-CO-O-(CH2)29CH3
Aroom. Struktuurivalem. |
Esteri nimi |
Apple
|
Etüüleeter 2-metüülbutaanhape |
Kirss
|
Amüülsipelghappe ester |
Pirn
|
Äädikhappe isoamüülester |
Ananass |
Võihappe etüülester (etüülbutüraat) |
Banaan |
Äädikhappe isobutüülester (isoamüülatsetaadil on ka banaanilõhn) |
Jasmiin
|
Bensüüleeteratsetaat (bensüülatsetaat) |
Estrite lühinimetused põhinevad alkoholijäägis oleva radikaali (R") ja happejäägi RCOO rühma nimetusel. Näiteks etüüläädikhape CH 3 COO C 2 H 5 helistas etüülatsetaat.

Rakendus
· Lõhna- ja lõhnatugevdajatena toiduaine- ja parfümeeriatööstuses (seebi, parfüümi, kreemide tootmine) tööstuses;
· Plasti ja kummi tootmisel plastifikaatoritena.

Plastifikaatorid – ained, mis lisatakse polümeermaterjalide koostisesse, et anda (või suurendada) elastsust ja (või) plastilisust töötlemise ja töötamise ajal.
Rakendus meditsiinis
19. sajandi lõpus ja 20. sajandi alguses, kui orgaaniline süntees tegi esimesi samme, sünteesisid ja testisid farmakoloogid palju estreid. Nendest said sellised ravimid nagu salool, validool jne. Metüülsalitsülaati kasutati laialdaselt lokaalse ärritaja ja valuvaigistina, mis on nüüdseks praktiliselt asendatud tõhusamate ravimitega.
Estrite valmistamine
Estreid saab saada karboksüülhapete reageerimisel alkoholidega ( esterdamisreaktsioon). Katalüsaatorid on mineraalhapped.
Esterdamisreaktsioon happekatalüüsil on pöörduv. Pöördprotsessi – estri lõhustamist vee toimel karboksüülhappeks ja alkoholiks – nimetatakse estri hüdrolüüs.
RCOOR " + H2O ( H +) ↔ RCOOH + R "OH
Hüdrolüüs leelise juuresolekul on pöördumatu (kuna tekkiv negatiivselt laetud karboksülaadi anioon RCOO ei reageeri nukleofiilse reagendiga - alkoholiga).
Seda reaktsiooni nimetatakse estrite seebistamine(analoogiliselt rasvade estersidemete aluselise hüdrolüüsiga seebi valmistamisel).
Rasvad, nende struktuur, omadused ja rakendused
"Keemia on kõikjal, keemia on kõiges:
Kõiges, mida me hingame
Kõiges, mida me joome
Kõiges, mida me sööme."
Kõiges, mida me kanname



Inimesed on juba ammu õppinud looduslikest esemetest rasva eraldama ja seda igapäevaelus kasutama. Rasv põles primitiivsetes lampides, valgustades ürgsete inimeste koopaid; jooksjad, millel laevu vette lasti, määriti rasvaga. Rasvad on meie toitumise peamine allikas. Kuid kehv toitumine ja istuv eluviis toovad kaasa ülekaalu. Kõrbeloomad talletavad rasva energia- ja veeallikana. Hüljeste ja vaalade paks rasvakiht aitab neil Põhja-Jäämere külmades vetes ujuda.
Rasvad on looduses laialt levinud. Koos süsivesikute ja valkudega on need osad kõigist loom- ja taimeorganismidest ning moodustavad meie toidu ühe peamise osa. Rasvade allikad on elusorganismid. Loomade hulka kuuluvad lehmad, sead, lambad, kanad, hülged, vaalad, haned, kalad (haid, tursk, heeringas). Tursa ja hai maksast saadakse ravimpreparaati kalaõli ning heeringast põllumajandusloomade toitmiseks kasutatavaid rasvu. Taimsed rasvad on enamasti vedelad ja neid nimetatakse õlideks. Kasutatakse taimerasvu nagu puuvill, lina, sojaoad, maapähklid, seesam, raps, päevalill, sinep, mais, mooni, kanep, kookospähkel, astelpaju, kibuvitsamarjad, õlipalm ja paljud teised.

Rasvad täidavad erinevaid funktsioone: ehitus-, energia- (1 g rasva annab 9 kcal energiat), kaitse-, säilitamis-. Rasvad annavad 50% inimesele vajalikust energiast, seega vajab inimene päevas 70–80 grammi rasva. Rasvad moodustavad terve inimese kehakaalust 10–20%. Rasvad on oluline rasvhapete allikas. Mõned rasvad sisaldavad vitamiine A, D, E, K ja hormoone.
Paljud loomad ja inimesed kasutavad rasva soojust isoleeriva kestana, näiteks mõnel mereloomal ulatub rasvakihi paksus meetrini. Lisaks on rasvad kehas lõhna- ja maitseainete ja värvainete lahustid. Paljud vitamiinid, näiteks A-vitamiin, on ainult rasvlahustuvad.
Mõned loomad (tavaliselt veelinnud) kasutavad rasvu oma lihaskiudude määrimiseks.
Rasvad suurendavad toidu küllastumist, kuna need seeditakse väga aeglaselt ja lükkavad edasi näljatunde tekkimist. .
Rasvade avastamise ajalugu
Veel 17. sajandil. Saksa teadlane, üks esimesi analüütilisi keemikuid Otto Tacheny(1652–1699) väitsid esmalt, et rasvad sisaldavad "varjatud hapet".
Aastal 1741 prantsuse keemik Claude Joseph Geoffroy(1685–1752) avastasid, et seebi (mis valmistati rasva keetmisel leelisega) lagunemisel happega moodustub mass, mis on katsudes rasvane.
Selle, et rasvad ja õlid sisaldavad glütseriini, avastas esmakordselt 1779. aastal kuulus Rootsi keemik. Karl Wilhelm Scheele.
Rasvade keemilise koostise määras esimest korda Prantsuse keemik eelmise sajandi alguses. Michel Eugene Chevreul, rasvade keemia rajaja, arvukate nende olemust käsitlevate uuringute autor, mis on kokku võetud kuueköitelises monograafias "Loomse päritoluga kehade keemilised uuringud".
1813 E. Chevreul rajas rasvade struktuuri tänu rasvade hüdrolüüsireaktsioonile aluselises keskkonnas.Ta näitas, et rasvad koosnevad glütseroolist ja rasvhapetest ning see ei ole lihtsalt nende segu, vaid ühend, mis vee lisamisel laguneb. glütserooliks ja hapeteks.
Rasvade süntees

1854. aastal viis prantsuse keemik Marcelin Berthelot (1827–1907) läbi esterdamisreaktsiooni ehk estri moodustamise glütserooli ja rasvhapete vahel ning sünteesis seega esimest korda rasva.

Rasvade (triglütseriidide) üldvalem

Rasvad
– glütserooli ja kõrgemate karboksüülhapete estrid.
Nende ühendite üldnimetus on triglütseriidid.
Rasvade klassifikatsioon



Loomsed rasvad sisaldavad peamiselt küllastunud hapete glütseriide ja on tahked ained. Taimsed rasvad, mida sageli nimetatakse õlideks, sisaldavad küllastumata karboksüülhapete glütseriide. Need on näiteks vedelad päevalille-, kanepi- ja linaseemneõlid.

Looduslikud rasvad sisaldavad järgmisi rasvhappeid
Küllastunud: steariin (C17H35COOH) palmitiin (C15H31COOH) Õline (C 3 H 7 COOH) |
SISALDAVAD LOOMAD RASVAD |
Küllastumata : oleiinhape (C17H33COOH, 1 kaksikside) linoolhape (C17H31COOH, 2 kaksiksidet) linoleen (C17H29COOH, 3 kaksiksidet) arahhidoon (C19H31COOH, 4 kaksiksidet, vähem levinud) |
SISALDAVAD TAIM RASVAD |
Rasvu leidub kõigis taimedes ja loomades. Need on täisglütseroolestrite segud ja neil ei ole selgelt määratletud sulamistemperatuuri.
· Loomsed rasvad(lambaliha, sealiha, veiseliha jne) on reeglina madala sulamistemperatuuriga tahked ained (erandiks on kalaõli). Tahketes rasvades on ülekaalus jäägid küllastunud happed
· Taimsed rasvad - õlid (päevalill, sojaoad, puuvillaseemned jne) – vedelikud (erand – kookosõli, kakaooavõi). Õlid sisaldavad peamiselt jääke küllastumata (küllastumata) happed
Rasvade keemilised omadused
1. hüdrolüüs, või seebistamine , rasv toimub vee mõjul ensüümide või happekatalüsaatorite osalusel (pöörduv), sel juhul moodustub alkohol - glütseriin ja karboksüülhapete segu:

või leelised (pöördumatu). Leeliseline hüdrolüüs tekitab kõrgemate rasvhapete sooli, mida nimetatakse seepideks. Seebid saadakse rasvade hüdrolüüsil leeliste juuresolekul:

Seebid on kõrgemate karboksüülhapete kaaliumi- ja naatriumisoolad.
2. Rasvade hüdrogeenimine – Vedelate taimeõlide muutmine tahketeks rasvadeks on toidu jaoks väga oluline. Õli hüdrogeenimise saadus on tahke rasv (kunstlik seapekk, salomas). Margariin– toidurasv, koosneb hüdrogeenitud õlide (päevalill, mais, puuvillaseemned jne), loomsete rasvade, piima ja maitselisandite (sool, suhkur, vitamiinid jne) segust.
Tööstuses toodetakse margariini järgmiselt:

Õli hüdrogeenimisprotsessi tingimustes (kõrge temperatuur, metallkatalüsaator) isomeriseeritakse osa cis C=C sidemeid sisaldavaid happejääke stabiilsemateks trans-isomeerideks. Suurenenud transküllastumata hapete jääkide sisaldus margariinis (eriti odavates sortides) suurendab ateroskleroosi, südame-veresoonkonna ja teiste haiguste riski.

Rasva tootmise reaktsioon (esterdamine)

Rasvade pealekandmine


Rasvad on toidutoode. Rasvade bioloogiline roll
Loomsed rasvad ja taimeõlid koos valkude ja süsivesikutega on inimese normaalse toitumise üks põhikomponente. Nad on põhiline energiaallikas: 1 g rasva täielikult oksüdeerituna (see esineb rakkudes hapniku osalusega) annab 9,5 kcal (umbes 40 kJ) energiat, mis on peaaegu kaks korda rohkem, kui on võimalik saada valgud või süsivesikud. Lisaks ei sisalda keha rasvavarud praktiliselt vett, samas kui valgu- ja süsivesikute molekulid on alati ümbritsetud veemolekulidega. Selle tulemusena annab üks gramm rasva peaaegu 6 korda rohkem energiat kui üks gramm loomset tärklist – glükogeeni. Seega tuleks rasva õigustatult pidada kõrge kalorsusega "kütuseks". Peamiselt kulub see inimkeha normaalse temperatuuri hoidmiseks, aga ka erinevate lihaste tööks, seega ka siis, kui inimene midagi ei tee (näiteks magab), vajab ta energiakulude katteks igas tunnis umbes 350 kJ energiat. , umbes sama võimsusega kui 100-vatisel elektripirnil.
Keha ebasoodsates tingimustes energiaga varustamiseks luuakse selles rasvavarud, mis ladestuvad nahaalusesse koesse, kõhukelme rasvvolti - nn omentumi. Nahaalune rasv kaitseb keha alajahtumise eest (see rasva funktsioon on eriti oluline mereloomadele). Inimesed on tuhandeid aastaid teinud rasket füüsilist tööd, mis nõudis palju energiat ja sellest tulenevalt ka toitumist. Inimese minimaalse ööpäevase energiavajaduse katmiseks piisab vaid 50 g rasvast. Mõõduka kehalise aktiivsuse korral peaks täiskasvanu aga saama toidust veidi rohkem rasvu, kuid nende kogus ei tohiks ületada 100 g (see annab kolmandiku ca 3000 kcal dieedi kalorisisaldusest). Tuleb märkida, et pool sellest 100 g-st sisaldub toidus nn peidetud rasvana. Rasvu sisaldavad peaaegu kõik toiduained: neid leidub väikestes kogustes isegi kartulis (seal 0,4%), leivas (1–2%) ja kaerahelves (6%). Piim sisaldab tavaliselt 2-3% rasva (aga on ka spetsiaalseid lõssi sorte). Peidetud rasva on tailihas üsna palju – 2–33%. Peidetud rasv sisaldub tootes üksikute pisikeste osakeste kujul. Peaaegu puhtad rasvad on seapekk ja taimeõli; Või sisaldab umbes 80% rasva ja ghee - 98%. Loomulikult on kõik antud rasvatarbimise soovitused keskmised, need sõltuvad soost ja vanusest, kehalisest aktiivsusest ja kliimatingimustest. Rasvade liigse tarbimisega võtab inimene kiiresti kaalus juurde, kuid ei tasu unustada, et kehas olevaid rasvu saab sünteesida ka teistest toiduainetest. Üleliigsete kalorite "väljatöötamine" füüsilise tegevuse kaudu ei ole nii lihtne. Näiteks pärast 7 km sörkimist kulutab inimene ligikaudu sama palju energiat, kui ta saab vaid sajagrammise šokolaaditahvli süües (35% rasva, 55% süsivesikuid) Füsioloogid on avastanud, et füüsilise koormuse korral on see 10 korda suurem. kui tavaliselt, oli rasvadieeti saanud inimene 1,5 tunni pärast täiesti kurnatud. Süsivesikute dieediga pidas inimene sama koormust vastu 4 tundi. See näiliselt paradoksaalne tulemus on seletatav biokeemiliste protsesside iseärasustega. Hoolimata rasvade suurest “energiaintensiivsusest”, on nendest energia saamine organismis aeglane protsess. Selle põhjuseks on rasvade, eriti nende süsivesinikahelate madal reaktsioonivõime. Kuigi süsivesikud annavad vähem energiat kui rasvad, vabastavad nad selle palju kiiremini. Seetõttu on enne kehalist aktiivsust eelistatav süüa magusat kui rasvast toitu.Rasvade liig toidus, eriti loomadel, suurendab riski haigestuda sellistesse haigustesse nagu ateroskleroos, südamepuudulikkus jne.. Loomsed rasvad sisaldavad palju kolesterooli ( kuid me ei tohiks unustada, et kaks kolmandikku kolesteroolist sünteesitakse kehas madala rasvasisaldusega toiduainetest – süsivesikutest ja valkudest).
Teadaolevalt peaksid olulise osa tarbitavast rasvast moodustama taimeõlid, mis sisaldavad organismile väga olulisi ühendeid – mitme kaksiksidemega polüküllastumata rasvhappeid. Neid happeid nimetatakse "olulisteks". Nagu vitamiinid, peavad nad kehasse sisenema valmis kujul. Neist suurima aktiivsusega on arahhidoonhape (seda sünteesitakse organismis linoolhappest), kõige vähem aga linoleenhappel (10 korda madalam kui linoolhappel). Erinevatel hinnangutel jääb inimese päevane linoolhappe vajadus vahemikku 4–10 g.Kõige suurem kogus linoolhapet (kuni 84%) on saflooriõlis, mis on pressitud ereoranžide õitega üheaastase taime safloori seemnetest. . Seda hapet on palju ka päevalille- ja pähkliõlis.
Toitumisspetsialistide sõnul peaks tasakaalustatud toit sisaldama 10% polüküllastumata happeid, 60% monoküllastumata happeid (peamiselt oleiinhapet) ja 30% küllastunud happeid. See on suhe, mis tagatakse, kui inimene saab kolmandiku rasvu vedelate taimeõlide kujul - 30–35 g päevas. Need õlid sisalduvad ka margariinis, mis sisaldab 15–22% küllastunud rasvhappeid, 27–49% küllastumata ja 30–54% polüküllastumata rasvhappeid. Võrdluseks: või sisaldab 45–50% küllastunud rasvhappeid, 22–27% küllastumata ja alla 1% polüküllastumata rasvhappeid. Sellega seoses on kvaliteetne margariin tervislikum kui või.
Peab meeles pidama!!!
Küllastunud rasvhapped mõjutavad negatiivselt rasvade ainevahetust, maksa tööd ja aitavad kaasa ateroskleroosi tekkele. Küllastumata happed (eriti linool- ja arahhidoonhapped) reguleerivad rasvade ainevahetust ja osalevad kolesterooli eemaldamises organismist. Mida suurem on küllastumata rasvhapete sisaldus, seda madalam on rasva sulamistemperatuur. Tahkete loomsete rasvade ja vedelate taimsete rasvade kalorisisaldus on ligikaudu sama, kuid taimsete rasvade füsioloogiline väärtus on palju suurem. Piimarasval on väärtuslikumad omadused. See sisaldab kolmandikku küllastumata rasvhappeid ja emulsioonina säilinud on organismis kergesti omastatav. Vaatamata nendele positiivsetele omadustele ei tohiks te tarbida ainult piimarasva, sest ükski rasv ei sisalda rasvhapete ideaalset koostist. Kõige parem on tarbida nii loomset kui taimset päritolu rasvu. Nende suhe peaks olema noorte ja keskealiste puhul 1:2,3 (70% loomset ja 30% taimset). Vanemate inimeste toidus peaksid ülekaalus olema taimsed rasvad.
Rasvad mitte ainult ei osale ainevahetusprotsessides, vaid neid hoitakse ka varus (peamiselt kõhuseinas ja neerude ümber). Rasvavarud tagavad ainevahetusprotsessid, säilitades valke kogu eluks. See rasv annab energiat nii füüsilisel aktiivsusel, kui toiduga varutakse vähe rasva, kui ka raskete haiguste korral, kui söögiisu vähenemise tõttu ei varustata seda toiduga piisavalt.
Liigne rasva tarbimine toidus on tervisele kahjulik: seda hoitakse suurtes kogustes varuks, mis suurendab kehakaalu, mis mõnikord põhjustab figuuri moonutamist. Selle kontsentratsioon veres suureneb, mis riskitegurina aitab kaasa ateroskleroosi, südame isheemiatõve, hüpertensiooni jne tekkele.
HARJUTUSED
1. Seal on 148 g kahe sama koostisega orgaanilise ühendi segu: C 3 H 6 O 2. Määrake nende sojaubade struktuur dieenium ja nende massifraktsioonid segus, kui on teada, et üks neist Liigse naatriumvesinikkarbonaadiga suhtlemisel eraldavad nad 22,4 l (n.s.) süsinikmonooksiidi ( IV) ja teine ei reageeri naatriumkarbonaadi ja hõbeoksiidi ammoniaagilahusega, kuid naatriumhüdroksiidi vesilahusega kuumutamisel moodustab see alkoholi ja happesoola.
Lahendus:
On teada, et süsinikmonooksiid ( IV ) vabaneb naatriumkarbonaadi reageerimisel happega. Koostisega C 3 H 6 O 2 võib olla ainult üks hape - propioon, CH 3 CH 2 COOH.
C 2 H 5 COOH + N aHCO 3 → C 2 H 5 COONa + CO 2 + H 2 O.
Seisundi järgi vabanes 22,4 liitrit CO 2, mis on 1 mol, mis tähendab, et segus oli ka 1 mol hapet. Algsete orgaaniliste ühendite molaarmass on: M (C3H6O2) = 74 g/mol, seega 148 g on 2 mol.
Teine ühend moodustab hüdrolüüsil alkoholi ja happesoola, mis tähendab, et see on ester:
RCOOR+ NaOH → RCOONa + R‘OH.
Koostis C 3 H 6 O 2 vastab kahele estrile: etüülformiaat HCOOC 2 H 5 ja metüülatsetaat CH 3 COOCH 3. Sipelghappe estrid reageerivad hõbeoksiidi ammoniaagilahusega, mistõttu esimene ester ei vasta probleemi tingimustele. Seetõttu on segu teine aine metüülatsetaat.
Kuna segu sisaldas ühte mooli sama molaarmassiga ühendeid, on nende massifraktsioonid võrdsed ja moodustavad 50%.
Vastus. 50% CH 3 CH 2 COOH, 50% CH 3 COOCH 3.
2. Estri auru suhteline tihedus vesiniku suhtes on 44. Selle estri hüdrolüüsi käigus moodustub kaks ühendit, mille põlemisel võrdsetes kogustes tekib (samadel tingimustel) võrdsed kogused süsihappegaasi. selle estri struktuurvalem.
Lahendus:
Küllastunud alkoholidest ja hapetest moodustunud estrite üldvalem on C n N 2 n O 2. N väärtuse saab määrata vesiniku tiheduse järgi:
M (CnH2nO2) = 14 n + 32 = 44. 2 = 88 g/mol,
kust n = 4, see tähendab, et eeter sisaldab 4 süsinikuaatomit. Kuna estri hüdrolüüsil tekkinud alkoholi ja happe põlemisel eraldub võrdne hulk süsinikdioksiidi, sisaldavad hape ja alkohol sama arvu süsinikuaatomeid, kumbki kaks. Seega moodustatakse soovitud ester äädikhappe ja etanooliga ning seda nimetatakse etüülatsetaadiks:
CH 3 - |
O-S 2 N 5 |
Vastus. Etüülatsetaat, CH 3 SOOC 2 H 5.
________________________________________________________________
3. Estri, mille molaarmass on 130 g/mol, hüdrolüüsil tekib hape A ja alkohol B. Määrata estri struktuur, kui on teada, et happe hõbedasool sisaldab 59,66% hõbedat. mass. Alkohol B ei oksüdeeru naatriumdikromaadiga ja reageerib kergesti vesinikkloriidhappega, moodustades alküülkloriidi.
Lahendus:
Estril on üldvalem RCOOR ‘. On teada, et happe hõbesool, RCOAg , sisaldab 59,66% hõbedat, seega on soola molaarmass: M (RCOOAg) = M (A g )/0,5966 = 181 g/mol, kust HÄRRA ) = 181-(12+2.16+108) = 29 g/mol. See radikaal on etüül, C 2 H 5 ja estri moodustas propioonhape: C2H5COOR'.
Teise radikaali molaarmass on: M (R') = M (C2H5COOR ') - M(C2H5COO) = 130-73 = 57 g/mol. Selle radikaali molekulvalem on C4H9. Vastavalt seisundile alkohol C 4 H 9 OH ei oksüdeeru Na 2 C r 2 O 7 ja reageerib kergesti HCl seetõttu on see alkohol tertsiaarne, (CH 3) 3 SON.
Seega moodustatakse soovitud ester propioonhappe ja tert-butanooli abil ning seda nimetatakse tert-butüülpropionaadiks:
CH 3 |
||
C2H5- |
C-O- |
C - CH 3 |
CH 3 |
Vastus . tert-butüülpropionaat.
________________________________________________________________
4. Kirjutage kaks võimalikku valemit rasva kohta, mille molekulis on 57 süsinikuaatomit ja mis reageerib joodiga vahekorras 1:2. Rasv sisaldab paarisarvu süsinikuaatomitega happejääke.
Lahendus:
Rasvade üldvalem:
kus R, R', R " - süsivesinikradikaalid, mis sisaldavad paaritu arvu süsinikuaatomeid (teine aatom happejäägist on osa -CO- rühmast). Kolm süsivesiniku radikaali moodustavad 57-6 = 51 süsinikuaatomit. Võib eeldada, et iga radikaal sisaldab 17 süsinikuaatomit.
Kuna üks rasvamolekul võib siduda kaks joodimolekuli, on kolme radikaali kohta kaks kaksiksidet või üks kolmikside. Kui ühes radikaalis on kaks kaksiksidet, sisaldab rasv linoolhappe jääki ( R = C 17 H 31) ja kaks steariinhappe jääki ( R' = R " = C 17 H 35). Kui kaks kaksiksidet on erinevates radikaalides, siis sisaldab rasv kahte oleiinhappe jääki ( R = R' = C17H33 ) ja steariinhappe jääk ( R " = C 17 H 35). Võimalikud rasvavalemid:
|
|
________________________________________________________________


5.

ÜLESANDED ISESEISVAKS LAHENDUSEKS
1. Mis on esterdamisreaktsioon?
2. Mis vahe on tahkete ja vedelate rasvade struktuuris?
3. Millised on rasvade keemilised omadused.
4. Esitage metüülformiaadi tootmise reaktsioonivõrrand.
5. Kirjutage kahe estri ja happe struktuurivalemid, mille koostis on C 3 H 6 O 2. Nimetage need ained rahvusvahelise nomenklatuuri järgi.
6. Kirjutage esterdamisreaktsioonide võrrandid: a) äädikhape ja 3-metüülbutanool-1; b) võihape ja propanool-1. Nimetage eetrid.
7. Mitu grammi rasva võeti, kui selle hüdrolüüsi tulemusena tekkinud happe hüdrogeenimiseks oleks vaja 13,44 liitrit vesinikku (N.S.)?
8. Arvutage 32 g äädikhappe ja 50 g 2-propanooli kuumutamisel kontsentreeritud väävelhappe juuresolekul moodustunud estri saagise massiosa, kui moodustub 24 g estrit.
9. 221 g kaaluva rasvaproovi hüdrolüüsimiseks oli vaja 150 g naatriumhüdroksiidi lahust leelismassifraktsiooniga 0,2. Paku välja algse rasva struktuurivalem.
10. Arvutage kaaliumhüdroksiidi lahuse maht, mille leelise massiosa on 0,25 ja tihedus 1,23 g/cm 3 15 g etaanhappe etüülestrist ja metaanhappest koosneva segu hüdrolüüsiks. propüülester ja propaanhappe metüülester.
VIDEOKOGEMUS
1. Milline reaktsioon on estrite tootmise aluseks: |
|
a) neutraliseerimine |
b) polümerisatsioon |
c) esterdamine |
d) hüdrogeenimine |
2. Mitu isomeerset estrit vastab valemile C 4 H 8 O 2: |
|
a) 2 |
|
Estrite olulisemad esindajad on rasvad.
Rasvad, õlid
Rasvad- need on glütserooli ja kõrgema üheaatomilisuse estrid. Selliste ühendite üldnimetus on triglütseriidid või triatsüülglütseroolid, kus atsüül on karboksüülhappe jääk -C(O)R. Looduslike triglütseriidide koostis sisaldab küllastunud hapete (palmitiinhape C 15 H 31 COOH, steariin C 17 H 35 COOH) ja küllastumata (oleiinhape C 17 H 33 COOH, linoolhape C 17 H 31 COOH) jääke. Kõrgematel karboksüülhapetel, mis on rasvade osa, on alati paarisarv süsinikuaatomeid (C 8 - C 18) ja hargnemata süsivesinike jääk. Looduslikud rasvad ja õlid on kõrgemate karboksüülhapete glütseriidide segud.
Rasvade koostist ja struktuuri saab kajastada üldvalemiga:

Esterdamine- estrite moodustumise reaktsioon.

Rasvade koostis võib sisaldada nii küllastunud kui ka küllastumata karboksüülhapete jääke erinevates kombinatsioonides.
Tavatingimustes on küllastumata hapete jääke sisaldavad rasvad enamasti vedelad. Neid nimetatakse õlid. Põhimõtteliselt on need taimset päritolu rasvad – linaseemne-, kanepi-, päevalille- ja muud õlid (erandiks on palmi- ja kookosõli – tavatingimustes tahked). Vähem levinud on loomset päritolu vedelad rasvad, näiteks kalaõli. Enamik loomse päritoluga looduslikke rasvu on tavatingimustes tahked (madalsulavad) ained ja sisaldavad peamiselt küllastunud karboksüülhapete jääke, näiteks lambarasv.
Rasvade koostis määrab nende füüsikalised ja keemilised omadused.
Rasvade füüsikalised omadused
Rasvad on vees lahustumatud, neil ei ole selget sulamistemperatuuri ja nende maht suureneb sulamisel oluliselt.
Rasvade agregaatolek on tahke, see on tingitud asjaolust, et rasvad sisaldavad küllastunud hapete jääke ja rasvamolekulid on võimelised tihedalt pakkima. Õlide koostis sisaldab cis-konfiguratsioonis küllastumata hapete jääke, seetõttu on molekulide tihe pakkimine võimatu ja agregatsiooni olek on vedel.
Rasvade keemilised omadused
Rasvad (õlid) on estrid ja neid iseloomustavad estrireaktsioonid.
On selge, et küllastumata karboksüülhapete jääke sisaldavate rasvade puhul on iseloomulikud kõik küllastumata ühendite reaktsioonid. Nad värvivad broomivett ja osalevad muudes liitumisreaktsioonides. Praktilises mõttes on kõige olulisem reaktsioon rasvade hüdrogeenimine. Tahked estrid saadakse vedelate rasvade hüdrogeenimisel. Just see reaktsioon on margariini – taimeõlidest saadud tahke rasva – tootmise aluseks. Tavaliselt saab seda protsessi kirjeldada reaktsioonivõrrandiga:

Kõik rasvad, nagu ka teised estrid, läbivad hüdrolüüsi:

Estrite hüdrolüüs on pöörduv reaktsioon. Hüdrolüüsiproduktide moodustumise tagamiseks viiakse see läbi leeliselises keskkonnas (leeliste või Na 2 CO 3 juuresolekul). Nendes tingimustes toimub rasvade hüdrolüüs pöörduvalt ja põhjustab karboksüülhapete soolade moodustumist, mida nimetatakse. leeliselises keskkonnas olevaid rasvu nimetatakse rasvade seebistamine.
Rasvade seebistamisel moodustuvad glütseriin ja seebid - kõrgemate karboksüülhapete naatriumi- ja kaaliumisoolad:
Seebistamine– rasvade aluseline hüdrolüüs, seebi tootmine.

Seep– kõrgemate küllastunud karboksüülhapete naatriumi (kaalium) soolade segud (naatriumseep - tahke, kaaliumseep - vedel).
Seebid on pindaktiivsed ained (lühendatult pindaktiivsed ained, pesuained). Seebi pesev toime tuleneb sellest, et seep emulgeerib rasvu. Seebid moodustavad saasteainetega mitselle (suhteliselt on need erinevate lisanditega rasvad).
Seebimolekuli lipofiilne osa lahustub saasteaines ja hüdrofiilne osa satub mitselli pinnale. Mitsellid laetakse ühtemoodi, seetõttu tõrjuvad ning saasteaine ja vesi muutuvad emulsiooniks (praktiliselt on tegu musta veega).

Seepi esineb ka vees, mis loob aluselise keskkonna.
Seepe ei saa kasutada kõvas ja merevees, kuna tekkivad kaltsiumi (magneesiumi) stearaadid on vees lahustumatud.

Nomenklatuur
Estrite nimetused on tuletatud nimetusest, süsivesinikradikaalist a ja happe nimetusest, milles lõpu “-oic acid” asemel kasutatakse järelliidet “at” (nagu anorgaaniliste soolade nimetustes: naatriumkarbonaat, kroomnitraat), näiteks:

(Molekulide fragmendid ja vastavad nimede fragmendid on esile tõstetud sama värviga.)
Estreid peetakse tavaliselt happe ja alkoholi vaheliste reaktsiooniproduktidena; näiteks butüülpropionaati võib pidada propioonhappe ja butanooli vahelise reaktsiooni tulemuseks.
Kui kasutada lähtehappe triviaalset nimetust, siis sisaldub ühendi nimetuses sõna “ester”, näiteks C 3 H 7 COOC 5 H 11 - võihappe amüülester.
Homoloogne seeria

Isomerism
Estritele on iseloomulik kolme tüüpi isomeeria:
1. Süsinikuahela isomeeria, algab happejäägi juurest butaanhappega, alkoholijäägi juurest - propüülalkoholiga, näiteks:
2. Estrirühma -CO-O- asendi isomeeria. Seda tüüpi isomeeria algab estritega, mille molekulid sisaldavad vähemalt 4 süsinikuaatomit, näiteks:
3. Klassidevaheline isomeeria, estrid (alküülalkanoaadid) on isomeersed kuni küllastunud monokarboksüülhapped; Näiteks:
Küllastumata hapet või küllastumata alkoholi sisaldavate estrite puhul on võimalik veel kahte tüüpi isomeeria: mitmiksideme asukoha isomeeria; cis-trans isomeeria.
Füüsikalised omadused
Hapete ja alkoholide madalamate homoloogide estrid on värvitud, madalal temperatuuril keevad meeldiva lõhnaga vedelikud; kasutatakse aromaatsete lisanditena toiduainetes ja parfümeerias. Estrid ei lahustu vees hästi.
Omandamise meetodid
1. Ekstraheeritud looduslikest toodetest
2. Hapete interaktsioon alkoholidega (esterdamisreaktsioonid); Näiteks:

Keemilised omadused
1. Estrite kõige tüüpilisemad reaktsioonid on happeline või aluseline hüdrolüüs (seebistamine). Need on reaktsioonid, mis on esterdamisreaktsioonide vastupidised. Näiteks:

2. Komplekssete eetrite redutseerimine (hüdrogeenimine), mille tulemusena tekivad alkoholid (üks või kaks); Näiteks:

Kui lähtehape on mitmealuseline, siis on võimalik kas täisestrite moodustumine - kõik HO rühmad on asendatud või happe estrid - osaline asendamine. Ühealuseliste hapete puhul on võimalikud ainult täisestrid (joonis 1).
Riis. 1. ESTRITE NÄITED anorgaanilise ja karboksüülhappe baasil
Estrite nomenklatuur.
Nimi luuakse järgmiselt: esiteks märgitakse happega seotud rühm R, seejärel happe nimi sufiksiga “at” (nagu anorgaaniliste soolade nimetustes: süsinik juures naatrium, nitraat juures kroom). Näited joonisel fig. 2

Riis. 2. ESTRITE NIMED. Molekulide fragmendid ja vastavad nimede fragmendid on esile tõstetud sama värviga. Estreid peetakse tavaliselt happe ja alkoholi vaheliste reaktsiooniproduktidena; näiteks butüülpropionaati võib pidada propioonhappe ja butanooli vahelise reaktsiooni tulemuseks.
Kui kasutate triviaalset ( cm. AINETE TRIVIALNE NIMETUS) lähtehappe nimetus, siis sisaldab ühendi nimetus sõna “ester”, näiteks C 3 H 7 COOC 5 H 11 - võihappe amüülester.
Estrite klassifikatsioon ja koostis.
Uuritud ja laialdaselt kasutatud estrite hulgas on enamus karboksüülhapetest saadud ühendeid. Mineraalsetel (anorgaanilistel) hapetel põhinevad estrid pole nii mitmekesised, sest mineraalhapete klass on vähem arvukas kui karboksüülhapped (ühendite mitmekesisus on üks orgaanilise keemia tunnuseid).
Kui C-aatomite arv algses karboksüülhappes ja alkoholis ei ületa 6–8, on vastavad estrid värvitud õlised vedelikud, enamasti puuviljalõhnaga. Nad moodustavad puuviljaestrite rühma. Kui estri moodustumisel osaleb aromaatne alkohol (sisaldab aromaatset tuuma), siis on sellistel ühenditel reeglina pigem lilleline kui puuviljalõhn. Kõik selle rühma ühendid on vees praktiliselt lahustumatud, kuid lahustuvad kergesti enamikes orgaanilistes lahustites. Need ühendid on huvitavad nende meeldivate lõhnade laia valiku tõttu (tabel 1), mõned neist eraldati algul taimedest ja sünteesiti hiljem kunstlikult.
| Tabel 1. MÕNED ESTRID, millel on puuvilja- või lillearoom (algsete alkoholide fragmendid liitvalemis ja nimes on paksus kirjas esile tõstetud) | ||
| Estri valem | Nimi | Aroom |
| CH 3 COO C4H9 | butüül atsetaat | pirn |
| C3H7COO CH 3 | Metüül Võihappe ester | õun |
| C3H7COO C2H5 | Etüül Võihappe ester | ananass |
| C 4 H 9 COO C2H5 | Etüül | karmiinpunane |
| C 4 H 9 COO C5H11 | Isoamil isovaleriinhappe ester | banaan |
| CH 3 COO CH2C6H5 | Bensüül atsetaat | jasmiin |
| C6H5COO CH2C6H5 | Bensüül bensoaat | lilleline |
Kui estrites sisalduvate orgaaniliste rühmade suurus suureneb C 15–30-ni, omandavad ühendid plastilise, kergesti pehmenevate ainete konsistentsi. Seda rühma nimetatakse vahadeks; need on tavaliselt lõhnatud. Mesilasvaha sisaldab erinevate estrite segu, üks vaha komponentidest, mis eraldati ja määrati koostis, on palmitiinhappe müritsüülester C 15 H 31 COOC 31 H 63. Hiina vaha (košenilli eritumise toode – Ida-Aasia putukad) sisaldab tseroothappe tserüülestrit C 25 H 51 COOC 26 H 53. Lisaks sisaldavad vahad ka vabu karboksüülhappeid ja alkohole, mis sisaldavad suuri orgaanilisi rühmi. Vahasid ei niisuta vesi ja need lahustuvad bensiinis, kloroformis ja benseenis.
Kolmas rühm on rasvad. Erinevalt kahest eelmisest ühehüdroksüülsetel alkoholidel ROH põhinevast rühmast on kõik rasvad estrid, mis on moodustunud kolmehüdroksüülsest alkoholist glütseroolist HOCH 2 – CH (OH) – CH 2 OH. Rasvadest koosnevatel karboksüülhapetel on tavaliselt 9–19 süsinikuaatomiga süsivesinikahel. Loomsed rasvad (lehmavõi, lambaliha, seapekk) on plastilised sulavad ained. Taimsed rasvad (oliivi-, puuvillaseemne-, päevalilleõli) on viskoossed vedelikud. Loomsed rasvad koosnevad peamiselt steariin- ja palmitiinhappe glütseriidide segust (joonis 3A, B). Taimeõlid sisaldavad veidi lühema süsinikuahela pikkusega hapete glütseriide: lauriin C 11 H 23 COOH ja mürist C 13 H 27 COOH. (nagu steariin- ja palmitiinhape, on need küllastunud happed). Selliseid õlisid saab pikka aega õhus säilitada, muutmata nende konsistentsi ja seetõttu nimetatakse neid mittekuivatavaks. Seevastu linaseemneõli sisaldab küllastumata linoolhappe glütseriidi (joonis 3B). Õhukese kihina pinnale kandmisel kuivab selline õli polümerisatsiooni käigus kaksiksidemetel õhuhapniku mõjul ning moodustub elastne kile, mis ei lahustu vees ja orgaanilistes lahustites. Looduslik kuivatusõli on valmistatud linaseemneõlist.

Riis. 3. STEARIIN- JA PALMITIHAPPE GLÜTSERIIDID (A JA B)– loomse rasva komponendid. Linoolhappe glütseriid (B) on linaseemneõli komponent.
Mineraalhapete estrid (alküülsulfaadid, madalamate alkoholide C1-8 fragmente sisaldavad alküülboraadid) on õlised vedelikud, kõrgemate alkoholide estrid (alates C9-st) on tahked ühendid.
Estrite keemilised omadused.
Karboksüülhapete estritele on kõige iseloomulikum estersideme hüdrolüütiline (vee mõjul) lõhustumine, neutraalses keskkonnas kulgeb see aeglaselt ja hapete või aluste juuresolekul märgatavalt kiireneb, kuna H + ja HO – ioonid katalüüsivad seda protsessi (joonis 4A), kusjuures hüdroksüülioonid toimivad tõhusamalt. Hüdrolüüsi leeliste juuresolekul nimetatakse seebistamiseks. Kui võtta kogu moodustunud happe neutraliseerimiseks piisav kogus leelist, toimub estri täielik seebistumine. See protsess viiakse läbi tööstuslikus mastaabis ning glütserool ja kõrgemad karboksüülhapped (C 15–19) saadakse leelismetallisoolade kujul, mis on seep (joonis 4B). Taimeõlides sisalduvate küllastumata hapete fragmendid, nagu kõik küllastumata ühendid, võivad olla hüdrogeenitud, vesinik kinnitub kaksiksidemetega ja moodustuvad loomsete rasvadega sarnased ühendid (joonis 4B). Seda meetodit kasutades toodetakse tööstuslikult päevalille-, soja- või maisiõli baasil tahkeid rasvu. Margariin on valmistatud taimsete õlide hüdrogeenimisproduktidest, mis on segatud looduslike loomsete rasvade ja erinevate toidulisanditega.

Peamine sünteesimeetod on karboksüülhappe ja alkoholi interaktsioon, mida katalüüsib hape ja millega kaasneb vee vabanemine. See reaktsioon on vastupidine joonisel fig. 3A. Et protsess kulgeks soovitud suunas (estri süntees), destilleeritakse (destilleeritakse) reaktsioonisegust vett. Märgitud aatomeid kasutavate spetsiaalsete uuringute abil õnnestus kindlaks teha, et sünteesi käigus eraldub happest (tähistatud punase punktiirraamiga) olev O-aatom, mis on osa saadud veest, mitte alkoholist ( realiseerimata valik on esile tõstetud sinise punktiirraamiga).
Sama skeemi abil saadakse anorgaaniliste hapete estrid, näiteks nitroglütseriin (joonis 5B). Hapete asemel võib kasutada happekloriide, meetod on rakendatav nii karboksüülhapete (joonis 5C) kui ka anorgaaniliste hapete (joonis 5D) puhul.
Karboksüülhappe soolade interaktsioon RCl halogeniididega viib samuti estrite tekkeni (joonis 5D), reaktsioon on mugav selle poolest, et see on pöördumatu – vabanenud anorgaaniline sool eemaldatakse koheselt orgaanilisest reaktsioonikeskkonnast sademe kujul.
Estrite kasutamine.
Tsellulooslakkide (nitrotselluloosi ja tselluloosatsetaadi baasil) lahustitena kasutatakse etüülformiaadi HCOOC 2 H 5 ja etüülatsetaati H 3 COOC 2 H 5.
Madalamatel alkoholidel ja hapetel põhinevaid estreid (tabel 1) kasutatakse toiduainetööstuses puuviljaessentside loomiseks, aromaatsete alkoholide baasil valmistatud estreid aga parfüümitööstuses.
Vahadest valmistatakse poleerimisvahendeid, määrdeaineid, immutuskompositsioone paberile (vahatatud paber) ja nahale, need sisalduvad ka kosmeetilistes kreemides ja ravimsalvides.
Rasvad koos süsivesikute ja valkudega moodustavad toitumiseks vajalike toiduainete komplekti, need on osa kõigist taime- ja loomarakkudest, lisaks täidavad nad kehas kogunedes energiavaru rolli. Tänu madalale soojusjuhtivusele kaitseb rasvakiht hästi loomi (eriti mereloomi – vaalu või morsaid) alajahtumise eest.
Loomsed ja taimsed rasvad on tooraine kõrgemate karboksüülhapete, detergentide ja glütserooli tootmiseks (joon. 4), mida kasutatakse kosmeetikatööstuses ja erinevate määrdeainete komponendina.
Nitroglütseriin (joonis 4) on tuntud ravim ja lõhkeaine, dünamiidi aluseks.
Kuivatusõlid on valmistatud taimeõlidest (joonis 3), mis on õlivärvide aluseks.
Väävelhappe estreid (joonis 2) kasutatakse orgaanilises sünteesis alküülivate (ühendisse alküülrühma sisseviimise) reagentidena ning fosforhappe estreid (joonis 5) kasutatakse putukamürkidena, samuti määrdeõlide lisandina.
Mihhail Levitski